Next Generation Sequencing (NGS)
DNA schnell und präzise sequenzieren
Als führendes Labor im Bereich Hämatopathologie bieten wir unseren Kunden eine der fortschrittlichsten Methoden für die Diagnostik: Next Generation Sequencing.
Wir nutzen Next Generation Sequencing, um Veränderungen im Genom von Zellen und Geweben zu erkennen, die mit verschiedenen Blutkrankheiten verbunden sind.


Definition
Was ist Next Generation Sequencing?
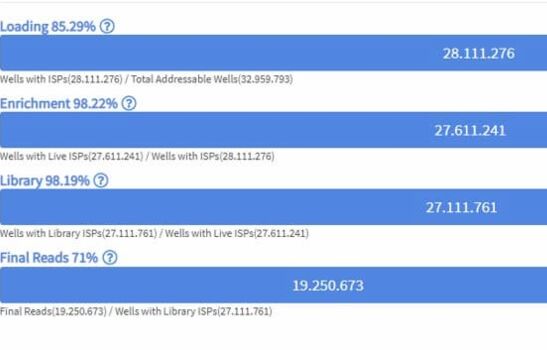
Next Generation Sequencing (NGS) ist eine moderne Technologie der DNA-Sequenzierung, die eine schnelle und kosteneffiziente Analyse von großen DNA-Mengen ermöglicht. Im Gegensatz zu herkömmlichen Sequenzierungsmethoden kann NGS in kürzerer Zeit eine größere Anzahl von Sequenzierungsläufen parallel durchführen.
Wie funktioniert Next Generation Sequencing?
Diese Technologie nutzt kurze DNA-Fragmente, um den gesamten Genom eines Probenmaterials zu entschlüsseln. Die Sequenzierung der einzelnen Fragmente erfolgt durch eine Kombination aus chemischen Reaktionen und High-Throughput-Detektionstechniken.
Die erzeugten Daten werden dann computergeneriert zu einem vollständigen Bild des Genoms zusammengesetzt.
In der Hämatopathologie Lübeck kommen für das NGS der ION Chef und der Sequenzierer ION S5 sowie der Genexus-Sequenzer von ThermoFisher Scientific zum Einsatz.
| Oncomine Myeloid Panel (MDS/MPN-Panel) |
Kodierregion: |
| Oncomine Focus Panel | Hotspots: AKT1, ALK, AR, BRAF, CDK4, CTNNB1, DDR2, EGFR, ERBB2, ERBB3, ERBB4, ESR1, FGFR2, FGFR3, GNA11, GNAQ, HRAS, IDH1, IDH2, JAK1, JAK2, JAK3, KIT, KRAS, MAP2K1, MAP2K2, MET, MTOR, NRAS, PDGFRA, PIK3CA, RAF1, RET, ROS1, SMO Fusionsgene: ABL1, AKT3, ALK, AXL, BRAF, EGFR, ERBB2, ERG, ETV1, ETV4, ETV5, FGFR1, FGFR2, FGFR3, MET, NTRK1, NTRK2, NTRK3, PDGFRA, PPARG, RAF1, RET, ROS1 |
| TP53 Panel | TP53 (Kodierregion) |
| BRCA plus Panel | Kodierregion: ATM, BRCA1, BRCA2, CHEK2, PALB2, RAD51C, RAD51D, NBN, CDH1, SMARCA4, TP53 |
| ECYT-Panel | Kodierregion: BPGM, EGLN1 (PHD2), EPAS1 (HIF2A), EPOR, VHL |
| BK-Panel |
|
| LymphoTrack |
|
| Melanom Panel |
Kodierregion: |
| Lymphom Panel |
Kodierregion: |
Einsatzgebiete von Next Generation Sequencing in der medizinischen Diagnostik
NGS bietet eine Vielzahl von Anwendungen in Bereichen wie der medizinischen Diagnostik, der Erforschung von Krankheitsmechanismen und der Identifizierung von genetischen Veränderungen, die bei bestimmten Erkrankungen beteiligt sind.
Es ermöglicht eine präzise Analyse von genetischen Mutationen, die für die Diagnostik und Überwachung von Blutkrankheiten, Tumoren und anderen genetisch bedingten Erkrankungen von großer Bedeutung sind.
Unsere Leistungen
Methoden in der Erregerdiagnostik
Es gibt eine Vielzahl von Methoden, die in der Erregerdiagnostik zum Einsatz kommen. Dazu gehören sowohl kulturelle als auch molekulare Methoden. Die Wahl der Methode hängt von verschiedenen Faktoren ab, wie z.B. der Art des Erregers, der vermuteten Infektion, der Verfügbarkeit von Material und der Dringlichkeit der Diagnose.
Kulturelle Methoden
Kulturelle Methoden werden eingesetzt, um Erreger auf Nährmedien zu züchten, um ihre Identität zu bestimmen und um ihre Empfindlichkeit gegenüber Antibiotika zu testen. Hierbei können verschiedene Kulturverfahren eingesetzt werden, wie z.B. das Anlegen von Blut- oder Urinkulturen, die Identifizierung von Pilzen und Parasiten durch spezielle Kulturmedien oder die Anzucht von Bakterien aus Abstrichen oder Gewebebiopsien.

Mikroskopie
Die Mikroskopie ist ein wichtiger Bestandteil der Erregerdiagnostik. Hierbei können Erreger direkt im klinischen Material nachgewiesen werden. Dies kann beispielsweise durch eine direkte Fluoreszenzfärbung, eine Gram-Färbung oder eine spezielle Färbemethode für Pilze oder Parasiten erfolgen..

Serologische Methoden
Serologische Methoden nutzen Antikörper gegen spezifische Erreger, um eine Infektion nachzuweisen. Hierbei können sowohl Antikörper im Blut des Patienten als auch Antigene des Erregers nachgewiesen werden. Beispiele für serologische Tests sind der ELISA (Enzyme-Linked Immunosorbent Assay), der Western Blot oder der Immunofluoreszenztest.

Molekulare Methoden
Molekulare Methoden sind in der Erregerdiagnostik sehr wichtig geworden, da sie es ermöglichen, schnell und zuverlässig Erreger nachzuweisen. Hierbei können spezifische DNA- oder RNA-Sequenzen des Erregers amplifiziert und nachgewiesen werden. Beispiele für molekulare Methoden sind die Polymerase-Kettenreaktion (PCR), die Reverse-Transkriptase-PCR (RT-PCR), die Ligase-Kettenreaktion (LKR) oder die Nukleinsäuresequenzierung.

Schnelltests
Schnelltests sind in der Erregerdiagnostik nützlich, da sie es ermöglichen, innerhalb kurzer Zeit eine erste Diagnose zu stellen. Hierbei können z.B. Schnelltests auf Influenzaviren, Streptokokken oder HIV eingesetzt werden.
Die Wahl der Methode hängt von verschiedenen Faktoren ab, wie z.B. der Art des Erregers, der vermuteten Infektion, der Verfügbarkeit von Material und der Dringlichkeit der Diagnose. In der Erregerdiagnostik setzen wir in unserem Labor eine Vielzahl von Methoden ein, um eine schnelle und präzise Diagnose zu stellen.
Vorteile
Next Generation Sequencing in der Hämapathologie
-
Höhere Genauigkeit
NGS ermöglicht eine höhere Genauigkeit bei der Sequenzierung von DNA-Proben, insbesondere bei der Analyse von genetischen Mutationen.
-
Geschwindigkeit
NGS kann eine größere Anzahl von Sequenzierungsläufen parallel durchführen, was zu einer deutlich schnelleren Analysezeit führt als bei herkömmlichen Methoden.
-
Kosteneffizienz
NGS ist eine kosteneffiziente Technologie, die es ermöglicht, große DNA-Mengen zu sequenzieren, ohne dass die Kosten explodieren.
-
Hohe Sensitivität
NGS kann auch kleine genetische Veränderungen erkennen, die mit herkömmlichen Methoden nicht nachgewiesen werden können.
-
Breite Anwendbarkeit
NGS kann in vielen Bereichen eingesetzt werden, wie z. B. in der Diagnostik, der Erforschung von Krankheitsmechanismen und der Identifizierung von genetischen Veränderungen, die bei bestimmten Erkrankungen beteiligt sind.